Повторить теоретический материал, решить предложенные для самостоятельной работы , задачи.
Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического»
Признак В реальных химических реакциях масса продукта всегда оказывается меньше расчетной. Почему?
- Многие химические реакции обратимы и не доходят до конца.
- При взаимодействии органических веществ часто образуются побочные продукты.
- При гетерогенных реакциях вещества плохо перемешиваются, и часть веществ просто не вступает в реакции.
- Часть газообразных веществ может улетучиться.
- При получении осадков часть вещества может остаться в растворе.
Вывод:
- масса теоретическая всегда больше практической;
- объём теоретический всегда больше объёма практического.
Теоретический выход составляет 100%, практический выход всегда меньше 100%.
Количество продукта, рассчитанное по уравнению реакции, - теоретический выход, соответствует 100%.
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой
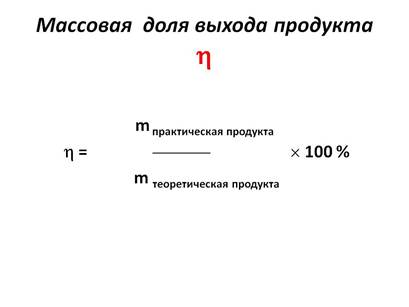
(эта), измеряется в процентах или долях.
Также для расчётов может использоваться количественный выход, исползуем отношение показателей количества вещества. В случае участия газов в реакции – отношение объёмов.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
Второй тип задач
Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
Третий тип задач
Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
Избыток и недостаток. Вещества реагируют друг с другом в строго определенных количествах. Однако исходные вещества для проведения реакции могут быть взяты в любых количествах. Таким образом, одно из реагирующих веществ может оказаться в избытке, а другое — в недостатке. В этом случае необходимо определить, какое из реагирующих веществ находится в избытке, а какое — в недостатке, и дальнейшие расчеты производить по веществу, находящемуся в недостатке. Это обусловлено тем, что вещество, находящееся в недостатке, прореагирует полностью, таким образом, количество вещества данного реагента нам будет точно известно.
Порядок решения задач
- Запишите кратко условие задачи.
- Запишите уравнение реакции.
- Над формулами веществ запишите данные по условию, приняв одно из известных за неизвестное.
- Найдите, какое из данных веществ расходуется полностью.
- По полностью израсходованному веществу найдите продукт реакции.
- Запишите ответ.
Задачи можно решать: 1. По пропорции, приняв одно из известных данных за неизвестное. 2. Через отношение значений количества вещества
Задача 4. Вычислите массу хлорида железа (III), образующегося при взаимодействии 14 г железа и 5,6 л (н. у.) хлора.
Задача 5. Определить массу осадка, выделившегося при пропускании 5,6л углекислого газа через известковую воду, Содержащую 11,1 гидроксида кальция.
Задача 6. Вычислите массу осадка, который образуется при добавлении 280г 20% раствора КОН к 160,2г 25% раствора хлорида алюминия.
Задача №1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
Задача №2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
Задача №3. Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
Расчет массы продукта по известной массе реагента, содержащего определённую долю примесей
Задание: Вычислить массу оксида кальция (СаО), получившегося при обжиге 300 г известняка (СаСО3), содержащего 10 % примесей.
|
№ п/п
|
Последовательность действий
|
Выполнение действий
|
|
1.
|
Записать уравнение химической реакции, поставить коэффициенты.
|
СаСО3 = СаО + СО2
|
|
2.
|
Рассчитать массу чистого СаСО3, содержащегося в известняке.
|
ω(чист.) = 100% - 10% = 90% или 0,9; m(CaCO3) = 300⋅0,9=270 г
|
|
3.
|
Полученную массу СаСО3 записать над формулой СаСО3 в уравнении реакции. Искомую массу СаО обозначить через х.
|
270 г х г
СаСО3 = СаО + СО2
|
|
4.
|
Под формулами веществ в уравнении записать количество вещества (согласно коэффициентам); произведения количеств веществ на их молярную массу.
|
270 г х г
СаСО3 = СаО + СО2
1 моль 1 моль
1⋅100 г 1⋅56 г
|
|
5.
|
Составить пропорцию.
|
270/100=х/56
|
|
6.
|
Решить уравнение.
|
х = 151,2 г
|
|
7.
|
Записать ответ.
|
Ответ: масса оксида кальция составит 151, 2 г
|
|