Ионные уравнения реакций 9Б 10.10 9А 12.10 химия
- Что такое реакции обмена?
- Что такое ионы?
- На какие группы делятся ионы?
- Что такое электролитическая диссоциация?
- На какие ионы распадаются при электролитической диссоциации кислоты
- На какие ионы распадаются при электролитической диссоциации растворимые основания?
- Именно эти ионы находятся в таблице растворимости: (Работа с таблицей растворимости – определение растворимых и нерастворимых веществ)
Реакции обмена протекают между ионами, поэтому называются реакции ионного обмена Выводится определение:
Реакции ионного обмена идут до конца в трех случаях:
- если образуется осадок – нерастворимое вещество после реакции)
- если выделяется газ
- если образуется вода
В остальных случаях реакции обмена являются обратимыми
1) Если образуется осадок Записать уравнения реакций в полном и сокращенном ионном виде
а) CuSO4 + 2NaOH  Na2SO4 + Cu(OH)2 Na2SO4 + Cu(OH)2
2) Если выделяется газ
а) CaCO3 + 2HNO3  Ca(NO3)2 + H2CO3 (H2O + CO2 Ca(NO3)2 + H2CO3 (H2O + CO2  ) )
3) Если образуется вода:
а) CuO + H2SO4 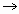 CuSO4 + H2O CuSO4 + H2O
4) Если НЕ образуются осадок, газ и вода, то реакции являются обратимыми и не имеют смысла
а) 2NaNO3 + CaCl2  Ca(NO3)2 + 2NaCl Ca(NO3)2 + 2NaCl
Для реакций ионного обмена составляют полные и сокращенные ионные уравнения. При этом на ионы никогда не раскладывают :
- нерастворимые вещества (см. таблицу растворимости);
- оксиды;
- воду;
- газы
1) Запишем молекулярное уравнение и уравняем его:
CuSO4 + 2NaOH 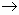 Na2SO4 + Cu(OH)2 Na2SO4 + Cu(OH)2
2) Разложим на ионы все, что возможно и затем сократим одинаковые ионы в обоих частях уравнения:
Cu+2 + SO4-2 + 2Na+1 + 2OH-1 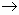 2Na+1 + SO4-2 + Cu(OH)2 2Na+1 + SO4-2 + Cu(OH)2  (полное ионное уравнение) (полное ионное уравнение)
3) Запишем то, что получилось:
Cu+2 + 2OH-1  Cu(OH)2 Cu(OH)2  (сокращенное ионное уравнение) (сокращенное ионное уравнение)
NaOH + HNO3  NaNO3 + H2O NaNO3 + H2O
K3PO4 + NaCl 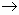 Na3PO4 + KCl Na3PO4 + KCl
NaOH + HCl 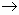 NaCl + H2O NaCl + H2O
1.Могут ли одновременно находиться в одном и том же растворе ионы
А) Ag+ и CI-
Б) Na+ и OH-
В) Сu2+ и OH-
Г) Ba2+ и SO42-
Д) Ba2+ и NO3-
Е) K+ и CI-
Приведите молекулярные уравнения реакций для следующих ионных:
А) 3Ca2+ + 2PO43- = Ca3(PO4)2↓
Б) Fe3+ + 3OH- = Fe(OH)3↓
В) 2H+ + S2- = H2S↑
|