Урок 24 10 кл Сложные эфиры и жиры. Сложные эфиры как продукты взаимодействия карбоновых кислот со спиртами. Применение сложных эфиров в пищевой и парфюмерной промышленности
Мыла как соли высших карбоновых кислот. Моющие свойства мыла. Химия в повседневной жизни. Моющие и чистящие средства. Средства личной гигиены и косметика.
Учить п16 до жиров стр 83. Второй темы в учебнике нет
Сложные эфиры — это вещества, которые образуются в результате взаимодействия органических или кислородсодержащих неорганических кислот со спиртами (реакции этерификации).
Общая формула сложных эфиров одноатомных спиртов и одноосновных карбоновых кислот:
R-COO-R, где R и R1 углеводородные радикалы, исключение – эфиры муравьиной кислоты
H–COO–R1.
Сложные эфиры – жидкости, обладающие приятными фруктовыми запахами. В воде они растворяются очень мало, но хорошо растворимы в спиртах. Сложные эфиры очень распространены в природе. Они даже могут находиться в коре некоторых деревьев.
Эфиры высших одноосновных кислот и высших одноатомных спиртов – основа природных восков. Воски не растворяются в воде. Их можно формовать в нагретом состоянии. Примерами животных восков могут служить пчелиный воск, а также ворвань (спермацет), содержащийся в черепной коробке кашалота (кашалотовый воск). Пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта – С31Н63ОН - (мирицилпальмитат): С15Н31СООС31Н63
Сложные эфиры часто служат исходными веществами в производстве многих фармацевтических препаратов.
Cложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации). Катализаторами являются минеральные кислоты.
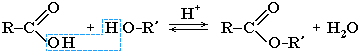
Обратный процесс – расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта – называют гидролизом сложного эфира.
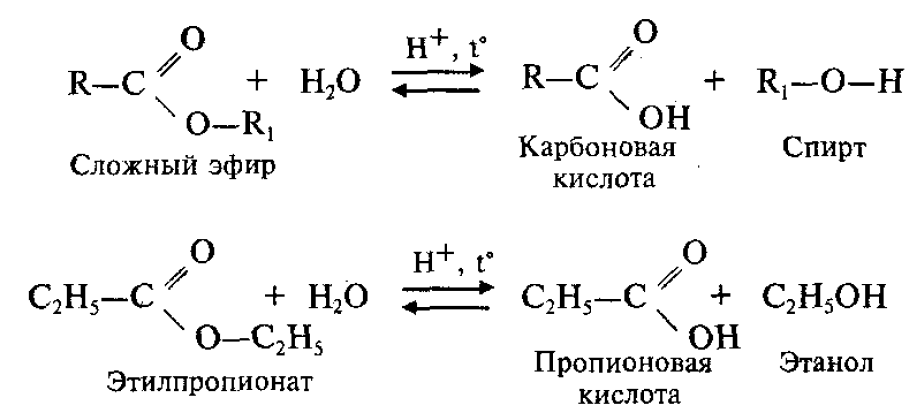
Гидролиз в присутствии щелочи протекает необратимо (т.к. образующийся отрицательно заряженный карбоксилат - анион RCOO– не вступает в реакцию с нуклеофильным реагентом – спиртом).
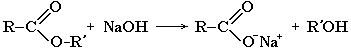
Эта реакция называется омылением сложного эфира.
https://resh.edu.ru/subject/lesson/5952/main/150635/ РЭШ Жиры. Моющие средства.
Если посмотреть на этикетку мыла, то на первом месте стоят – натриевые соли масел и жиров. Обычные мыла состоят главным образом из смеси солей пальмитиновой, стеариновой и олеиновой кислот. Натриевые соли образуют твердые мыла, калиевые соли — жидкие мыла.
Мыло – натриевые или калиевые соли высших карбоновых кислот,
полученные в результате гидролиза жиров в щелочной среде.
Общая формула твердого мыла: R-COONa; жидкого мыла: R-COOK. Получают мыло в результате щелочного гидролиза жира: Основываясь на этой реакции, французский химик М.Э.Шеврёль поставил производство мыла на научную основу.
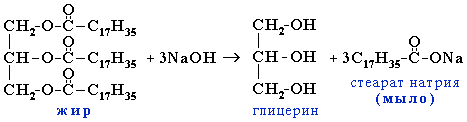
Основной состав любого твердого мыла одинаков. Это натриевые соли высших карбоновых кислот, обычно получаемых из жиров природного происхождения. Отличия заключаются в добавках, которые вносят в мыло в зависимости от его назначения. Основное назначение мыла – гигиеническое. Отрицательным свойством мыла является образование свободной щелочи при его растворении в воде. Щелочь эта может вызывать раздражение, шелушение, сухость кожи.
Натриевые соли высших кислот RCOONa имеют твердое агрегатное состояние, а калиевые RCOOK — жидкое (жидкое мыло). При изготовлении мыла в него добавляют душистые вещества, глицерин, красители, антисептики, растительные экстракты. Однако с химической точки зрения все мыла одинаковы (диссоциируют как сильные электролиты согласно уравнению RCOONa → RCOO- + Na+) и природа их действия во всех случаях одна и та же.
Очищающее действие мыла — сложный процесс. Молекула соли высшей карбоновой кислоты имеет полярную ионную часть (—COO-Na+) и неполярный углеводородный радикал, содержащий 12—18 атомов углерода. Полярная часть молекулы растворима в воде (гидрофильна), а неполярная — в жирах и других малополярных веществах (гидрофобна) .
В обычных условиях частицы жира или масла слипаются между собой, образуя в водной среде отдельную фазу. В присутствии мыла картина резко изменяется. Неполярные концы молекулы мыла погружаются в капли масла, а полярные карбоксилат-анионы остаются в водном растворе. В результате отталкивания одноименных зарядов на поверхности масла оно разбивается на мельчайшие частицы, каждая из которых имеет ионную оболочку из анионов —СОО-. Наличие этой оболочки препятствует слиянию частиц, в результате чего образуется устойчивая эмульсия масла в воде. Эмульгирование жира, содержащего грязь, обусловливает очищающее действие мыла
Этапы растворения грязи под действием мыла:
- При соприкосновении мыла с грязью, гидрофобная часть мыла окружает гидрофобное загрязняющее вещество и проникает внутрь, а поверхность загрязнения покрывается оболочкой гидрофильных групп.
- Гидрофильная часть мыла взаимодействуют с полярными молекулами воды.
- Ионы мыла «захватывают» загрязнение и отрываются от поверхности, переходя в воду.
- Плавающие частицы удерживаются в растворе до его смены.
В жесткой воде, содержащей ионы Са2+ и Mg2+, мыло теряет свою моющую способность. Это происходит в результате того, что кальциевые и магниевые соли высших карбоновых кислот нерастворимы в воде:

Вместо пены в воде образуются хлопья осадка, и мыло расходуется бесполезно.
Этого недостатка лишены синтетические моющие средства— современные стиральные порошки.
Принцип действия синтетических моющих средств точно такой же, как и у мыла, однако они имеют значительные преимущества. Во-первых, их растворы имеют нейтральную, а не щелочную среду. Во-вторых, синтетические моющие средства сохраняют свое действие в жесткой и даже морской воде, поскольку их кальциевые и магниевые соли растворимы. Вместе с тем остатки стиральных порошков в сточных водах очень медленно разлагаются биологическим путем и вызывают загрязнение окружающей среды.
|